Ringkesan
Identifikasi cepet tanduran transgenik
Teks/Tong Yucheng
Operasi eksperimental/Han Ying
Editor/Wen Youjun
Tembung/1600+
Wektu maca sing disaranake / 8-10 menit
Identifikasi cepet tanduran transgenik
Minangka wong anyar ing laboratorium, iku dudu proyek apik kanggo layar metu tetanduran positif saka Bunch saka tetanduran karo tingkat konversi kurang.Kaping pisanan, DNA kudu diekstrak saka akeh sampel siji-siji, banjur gen asing bakal dideteksi dening PCR.Nanging, asil asring blanks lan band karo sawetara item sok-sok, nanging ora bisa kanggo nemtokake apa ana deteksi ora kejawab utawa deteksi palsu..Apa banget ora bisa ngadhepi proses lan asil eksperimen kasebut?Aja kuwatir, kakang mulang sampeyan carane nyaring tanduran positif transgenik kanthi gampang lan akurat.
Langkah 1: Primer deteksi desain
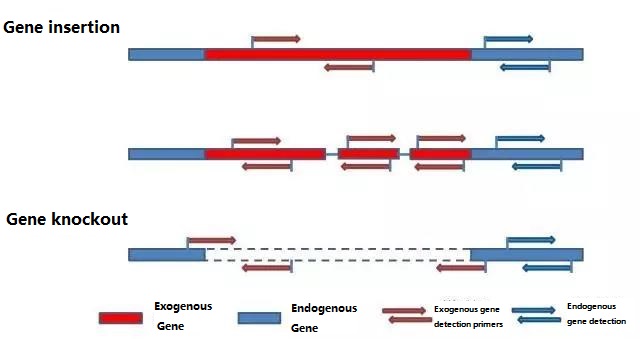
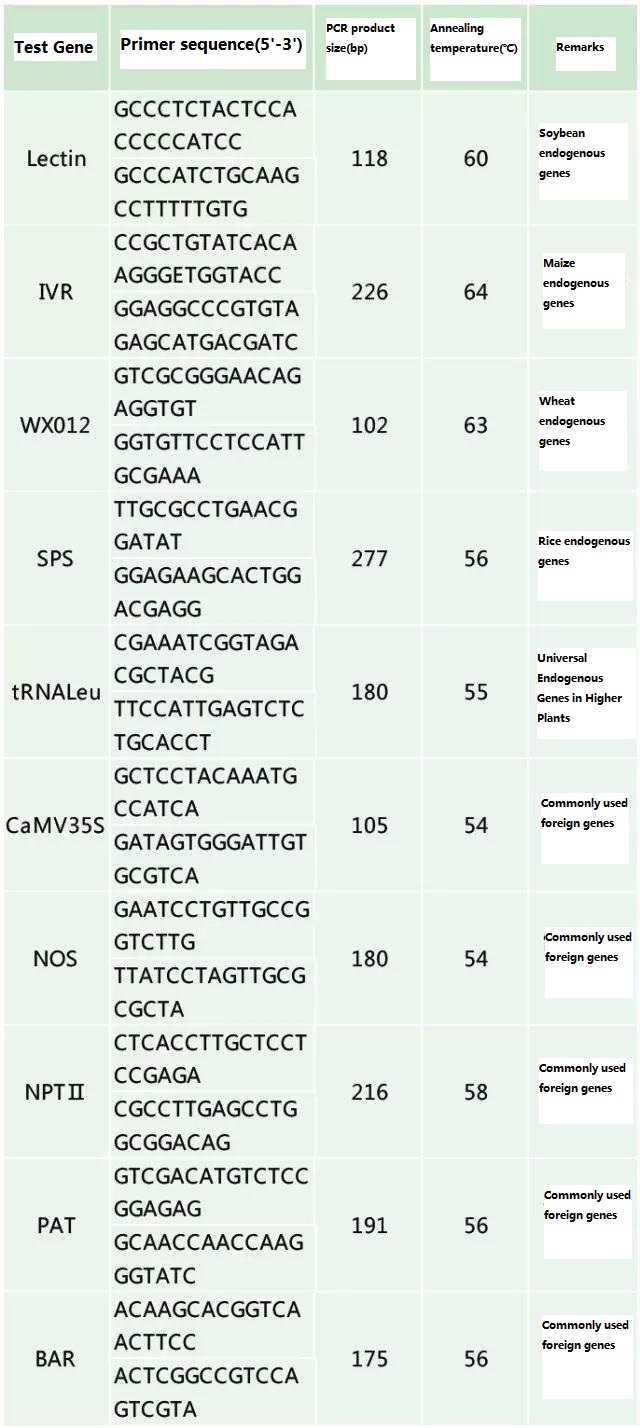
Nemtokake gen endogen lan gen eksogen sing bakal dideteksi miturut sampel sing bakal diuji, lan pilih urutan wakil 100-500bp ing gen kanggo desain primer.Primer sing apik bisa njamin akurasi asil deteksi lan nyepetake wektu deteksi (pirsani lampiran kanggo primer deteksi sing umum digunakake).
Cathetan:
Primer sing mentas dirancang kudu ngoptimalake kahanan reaksi lan verifikasi akurasi, presisi, lan watesan deteksi deteksi sadurunge nindakake deteksi skala gedhe.
Langkah 2:Ngembangake protokol eksperimen

Kontrol positif: Gunakake DNA sing diresiki ngemot fragmen target minangka cithakan kanggo nemtokake manawa sistem reaksi PCR lan kahanan normal.
Kontrol negatif/kosong: Gunakake cithakan DNA utawa ddH2O sing ora ngemot fragmen target minangka cithakan kanggo ndeteksi manawa ana sumber kontaminasi ing sistem PCR.
Kontrol referensi internal: nggunakake kombinasi primer / probe saka gen endogen saka sampel kanggo dites kanggo ngevaluasi cithakan bisa dideteksi dening PCR.
Cathetan:
Kontrol positif, negatif/kosong lan kontrol internal kudu disetel kanggo saben tes kanggo ngevaluasi validitas asil eksperimen.
Langkah 3: Persiapan eksperimen

Sadurunge digunakake, priksa manawa solusi kasebut dicampur kanthi rata.Yen udan ditemokake, kudu dibubarake lan dicampur miturut pandhuan sadurunge digunakake.2×PCR campuran kudu pipetted lan dicampur bola-bali karo micropipette sadurunge digunakake kanggo nyegah distribusi ion ora rata.
Cathetan:
Njupuk instruksi kasebut lan waca kanthi teliti, lan gawe persiapan sadurunge eksperimen kanthi ketat karo instruksi kasebut.
Langkah 4: Siapke sistem reaksi PCR
Miturut protokol eksperimen, nyampur primer, H2O, 2×PCR campuran, centrifuge lan disebaraké kanggo saben tabung reaksi.
Cathetan:
Kanggo tes skala gedhe utawa jangka panjang, disaranake nggunakake sistem reaksi PCR sing ngemot enzim UNG, sing bisa nyegah kontaminasi aerosol sing disebabake dening produk PCR.
Langkah 5: Tambah template reaksi

Nggunakake teknologi Direct PCR, ora perlu proses pemurnian asam nukleat sing mboseni.Cithakan sampel bisa disiapake sajrone 10 menit lan ditambahake menyang sistem reaksi PCR sing cocog.
Cathetan:
Cara Lysis nduweni efek deteksi sing luwih apik, lan produk sing dipikolehi bisa digunakake kanggo macem-macem reaksi deteksi.
5.1: PCR langsung saka godhong
Miturut ukuran gambar ing manual, potong jaringan godhong kanthi diameter 2-3mm lan lebokake ing sistem reaksi PCR.
Cathetan: Pesthekake yen fragmen godhong wis rampung kacemplungake ing solusi reaksi PCR, lan aja nambah jaringan godhong sing berlebihan.
5.2: Metode lisis godhong
Potong jaringan godhong kanthi diameter 5-7mm lan lebokake ing tabung centrifuge.Yen sampeyan milih godhong diwasa, aja nganggo jaringan urat utama godhong.Pipet 50ul Buffer P1 lysate menyang tabung centrifuge kanggo mesthekake yen lysate bisa rampung kacemplungaken tissue rwaning, Panggonan ing cycler termal utawa siram logam, lan lyse ing 95 ° C kanggo 5-10 menit.


Tambah 50ul Buffer P2 solusi netralisasi lan nyampur uga.Lysate asil bisa digunakake minangka cithakan lan ditambahake menyang sistem reaksi PCR.
Cathetan: Jumlah cithakan kudu ana ing antarane 5-10% saka sistem PCR, lan ora ngluwihi 20% (contone, ing sistem PCR 20μl, tambahake 1-2μl buffer lisis, ora luwih saka 4μl).
Langkah 6: Reaksi PCR

Sawise sentrifugasi tabung reaksi PCR, lebokake ing instrumen PCR kanggo amplifikasi.
Cathetan:
Reaksi kasebut nggunakake cithakan sing ora diresiki kanggo amplifikasi, mula jumlah siklus amplifikasi 5-10 siklus luwih akeh tinimbang nalika nggunakake cithakan DNA sing diresiki.
Langkah 7: Deteksi elektroforesis lan analisis asil

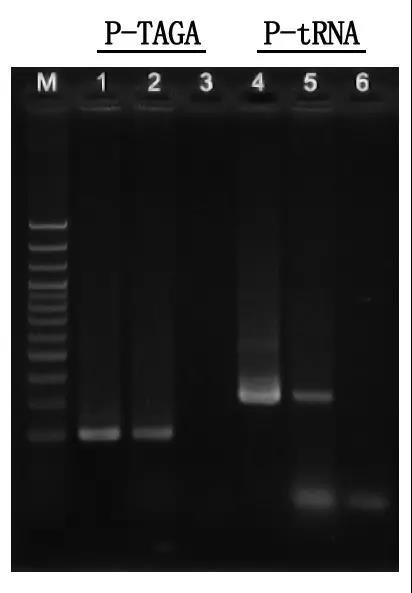
M: Tangga DNA 100bp
1\4: Metode DNA dimurnèkaké
2\5: Metode PCR langsung
3\6: Kontrol kosong
Kontrol kualitas:
Asil tes saka macem-macem kontrol sing disetel ing eksperimen kudu memenuhi syarat ing ngisor iki.Yen ora, panyebab masalah kasebut kudu dianalisis, lan tes kudu ditindakake maneh sawise masalah kasebut diilangi.
Tabel 1. Asil tes normal saka macem-macem kelompok kontrol

*Yen plasmid digunakake minangka kontrol positif, asil tes gen endogen bisa negatif
Hasil putusan:
A. Asil tes saka gen endogen saka sampel kasebut negatif, nuduhake yen DNA sing cocok kanggo deteksi PCR biasa ora bisa diekstrak saka sampel utawa DNA sing diekstrak ngandhut inhibitor reaksi PCR, lan DNA kudu diekstrak maneh.
B. Asil tes saka gen endogen saka sampel kasebut positif, lan asil tes saka gen eksogen negatif, nuduhake yen DNA sing cocok kanggo deteksi PCR biasa diekstrak saka sampel, lan bisa dianggep yen gen XXX ora dideteksi ing sampel.
C. Asil tes saka gen endogen saka sampel kasebut positif, lan asil tes saka gen eksogen positif, nuduhake yen DNA sing cocok kanggo deteksi PCR biasa wis diekstrak saka sampel, lan sampel DNA ngandhut gen XXX.Eksperimen konfirmasi bisa ditindakake maneh.
Langkah 8: Desain dhasar deteksi

Sawise eksperimen, gunakake larutan natrium hipoklorit 2% lan larutan etanol 70% kanggo ngusap area eksperimen kanggo nyegah polusi lingkungan.
Lampiran
Tabel 2. Primer sing umum digunakake kanggo deteksi PCR umum tanduran sing diowahi sacara genetis
Dokumen referensi:
SN/T 1202-2010, Metode deteksi PCR kualitatif kanggo bahan tanduran sing diowahi sacara genetis ing panganan.
Pengumuman Kementerian Pertanian 1485-5-2010, Pengujian bahan tanduran sing diowahi sacara genetis lan produke-beras M12 lan turunane.
Wektu kirim: Jun-09-2021








